IMRAM
Institute of Multidisciplinary Research for Advanced Materials, Tohoku University
東北大学
多元物質科学研究所

LAST UPDATE 2021/05/01
-
研究者氏名
Researcher Name門倉広 Hiroshi KADOKURA
准教授 Associate Professor -
所属
Professional Affiliation東北大学多元物質科学研究所
有機・生命科学研究部門 生体分子構造研究分野
Institute of Multidisciplinary Research for Advanced Materials, Tohoku University
Division of Organic- and Bio-materials Research, Biomolecular Structure -
研究キーワード
Research Keywords分泌タンパク質
細胞生物学
タンパク質の立体構造形成と品質管理
哺乳動物細胞
Secretory protein
Cell biology
Protein folding and quality control
Mammalian cells
- 研究テーマ
Research Subject -
哺乳動物細胞小胞体内におけるタンパク質のジスルフィド結合形成機構
Mechanisms of protein disulfide bond formation in the ER of mammalian cells
研究の背景 Background
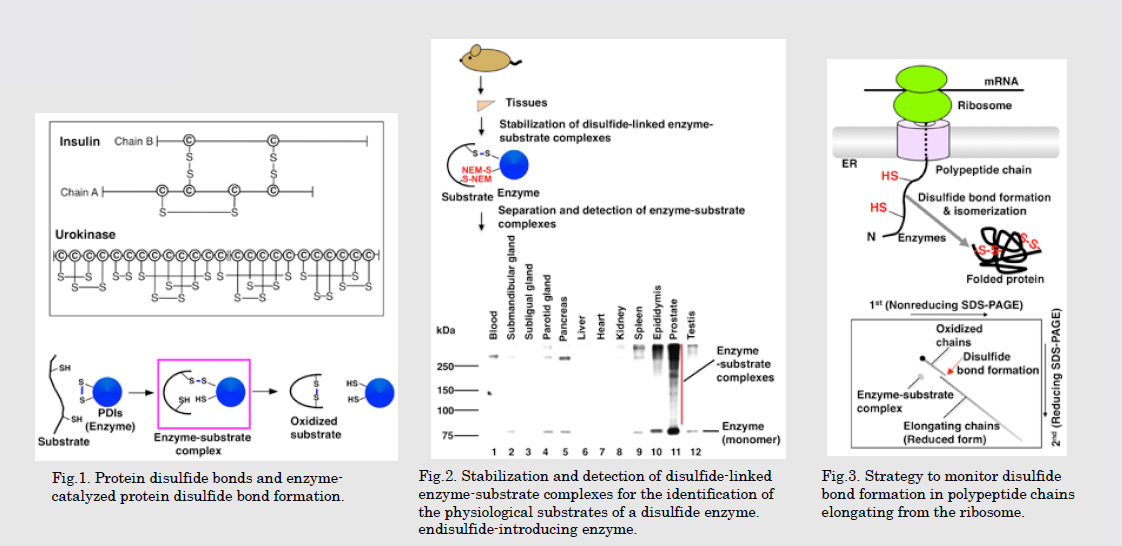
インスリンなどの、細胞の外で働くタンパク質が正しい立体構造をとり、機能を発揮するためにはジスルフィド結合が正確に導入される必要があります。ジスルフィド結合が効率よく形成されないと糖尿病などの疾患の原因となります。更に、抗体やホルモンなど医薬品として重要なタンパク質を微生物で生産するにはジスルフィド結合をうまく導入できるかどうかが鍵になります。よって、ジスルフィド結合形成の仕組の解明は、基礎生物学だけでなく医学や産業の発展にも重要です。
Disulfide bond formation is crucial for the folding and activity of numerous secretory proteins including insulin. Lack of formation of proper disulfide bonds in human can lead to disease such as diabetes. Further, disulfide bond formation is a key for the production of useful proteins of human origin (e.g. hormones and antibodies) using microorganisms. Thus, understanding the mechanisms of disulfide bond formation is important for the advance of science and technology
研究の目標 Outcome
哺乳動物の小胞体にはジスルフィド結合形成に働くと考えられる酵素が20種類以上存在します。個々の酵素の役割の違いや、インスリン等の重要タンパク質にジスルフィド結合が導入される仕組みを解明することを目指して、哺乳動物細胞を材料に、細胞生物学、プロテオミクス、化学遺伝学などの手法を利用しています。将来的には、得られる基礎的な知見を疾病の改善や有用タンパク質の生産に役立てたいと考えています。
Mammalian cells have more than 20 enzymes implicated in disulfide bond formation. To understand the role of each enzyme and the mechanisms of disulfide bond formation in proteins such as insulin, we use mammalian cells and techniques of cell biology, proteomics, and chemical genetics. In the future, we aim to adopt the knowledge for the remedy of disease and production of useful proteins.
研究図Research Figure
文献 / Publications
Science 303, 534 (2004). Cell 138, 1164 (2009). Antioxid. Redox Signal. 13, 1231 (2010). Science 331, 586 (2011). Science 337, 1665 (2012). Biochem. Biophys. Res. Commun. 440, 245 (2013). J. Biol Chem. 289, 27004 (2014). Free Radic. Biol. Med.in press(2015)
研究者HP
- hiroshi.kadokura.b3
 tohoku.ac.jp
tohoku.ac.jp - http://www.tagen.tohoku.ac.jp/labo/inaba/