IMCE
Institute for Materials Chemistry and Engineering, Kyushu University
九州大学
先導物質化学研究所

LAST UPDATE 2017/02/25
-
研究者氏名
Researcher Name塩田淑仁 Yoshihito SHIOTA
准教授 Associate Professor -
所属
Professional Affiliation九州大学先導物質化学研究所
物質基盤化学部門
Institute for Materials Chemistry and Engineering, Kyushu University
Division of Fundamental Organic Chemistry -
研究キーワード
Research Keywords量子化学
電子状態
反応機構解析
酵素反応
Quantum Chemistry
Electronic structure
Reaction mechanism
Enzymatic reaction
- 研究テーマ
Research Subject -
量子化学計算による化学反応の機構解析
Theoretical study of active sites and mechanism for chemical reaction
研究の背景 Background
遷移金属元素は、触媒では活性点として、生体内では酵素の活性中心として、高い選択性や温和な条件で反応をコントロールし、極めて高効率で物質の変換を行っている。このように遷移金属元素は微量ながら、触媒や酵素の活性点できわめて重要な役割を果たしている。それらの反応は一見すると単純な反応であっても複雑な素反応の組み合わせで進行していると考えられている。そのため、反応機構を明らかにするためには、素反応レベルでの理解を欠かすことができない。しかし,優れた実験手法を用いたとしてもその反応機構を実験的手法のみで完全に解明することは困難であり、理論化学、特に量子化学計算のサポートが必要とされている。
Transition metal compounds as active site play an important role in enzymatic reactions under the mild condition. To gain a better understanding of the complicated reaction mechanism we perform theoretical calculations based the quantum chemistry. These calculations provide the mechanistic insight into the enzymatic reaction that involves the multi-step reaction. Density functional theory (DFT) calculations on high-valent metal-oxo complexes have explained a number of experimental facts.
研究の目標 Outcome
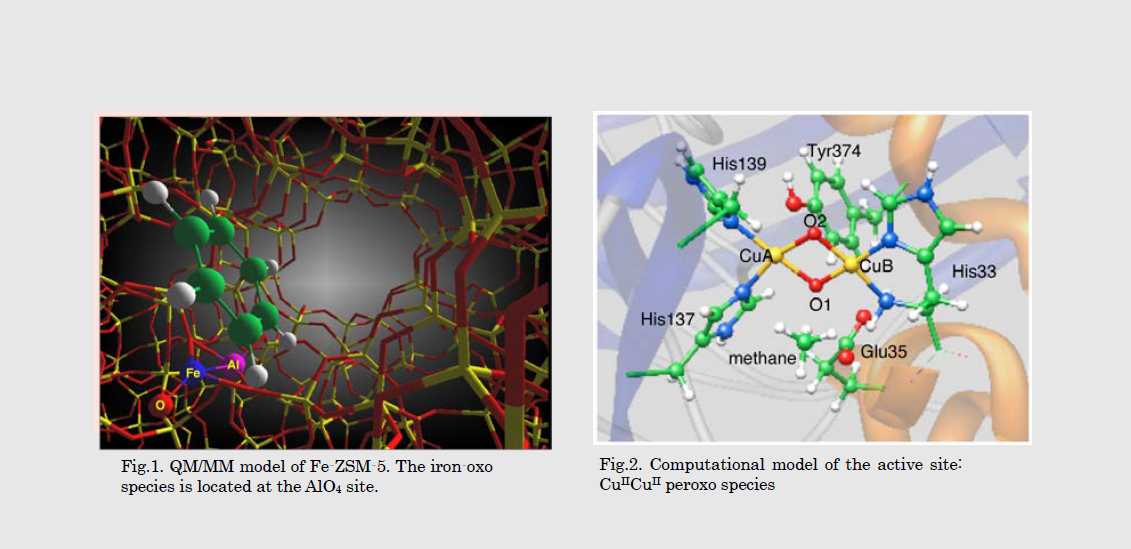
酵素反応や触媒反応の原動力となる金属活性種の電子構造およびその反応性について探索するため、量子化学計算による反応解析の理論研究を展開する。酵素はメタン活性化などの困難な化学反応を常温常圧で高選択的に触媒しており、これらの生体反応は主にタンパク質環境下にある金属活性点で起こる。反応素過程で生成する中間体のスピン状態変化およびタンパク質中の電子移動が、金属の関与する酵素反応触媒反応を理解するための鍵となる。特にその遷移状態の構造を知るための量子化学計算は有効な研究手段となる。
The design of greener chemical processes has become a top priority in recent years. In this sense, studies on methods for highly selective and efficient conversion of abundant organic resources into valuable products with metal complexes as catalysts are very important. Highvalent metal-oxo species are often key intermediates in such catalytic reactions. These complexes often mimic enzyme active centers responsible for biological oxidation and oxygenation of hydrocarbons.
研究図Research Figure
文献 / Publications
錯体化学選書10 金属錯体の量子•計算化学(2014) ACS Catalysis, 4, 2075-2085 (2014). J. Phys. Org. Chem., 28, 181-86 (2014). Chem. Sci. 5, 1429-1436 (2014). Chem. Sci. 5 2282-2292 (2014). Chem. Eur. J., 20, 15518-15532 (2014). Nat. Chem., 6, 1079-1083 (2014). Inorg. Chem., 53, 12677-12679 (2014).
研究者HP
- shiota
 ms.ifoc.kyushu-u.ac.jp
ms.ifoc.kyushu-u.ac.jp - http://trout.scc.kyushu-u.ac.jp/yoshizawaJ/