
IMRAM
Institute of Multidisciplinary Research for Advanced Materials, Tohoku University
東北大学
多元物質科学研究所

LAST UPDATE 2021/05/01
-
研究者氏名
Researcher Name高橋聡 Satoshi TAKAHASHI
教授 Professor -
所属
Affiliation東北大学 多元物質科学研究所
有機・生命科学研究部門 生命分子ダイナミクス研究分野
Institute of Multidisciplinary Research for Advanced Materials, Tohoku University
Division of Organic-and Bio-materials Research, Biological and Molecular Dynamics -
研究キーワード
Research Keywordsタンパク質のフォールディングとデザイン
癌抑制タンパク質 p53 の機能
一分子蛍光分光法
一分子選別装置
Protein folding and design
Tumor suppressor p53
Single molecule fluorescence spectroscopy
Single molecule sorting device
- 研究テーマ
Research Subject -
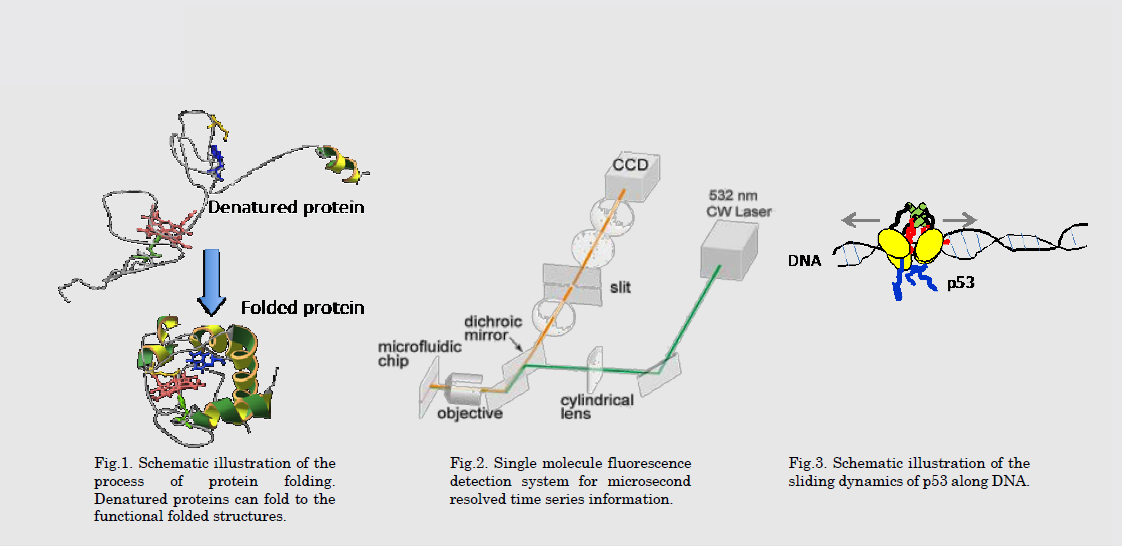
一分子蛍光観察によるタンパク質のフォールディングと機能の解明
Dynamics of proteins based on single molecule fluorescence detection
研究の背景 Background of the Research
タンパク質は、20種類のアミノ酸が一次元的に結合した高分子であり、生物が必要とする多様な機能を発揮する究極の機能性分子です。タンパク質が機能を発揮するには、特定の構造に折り畳まれ(フォールディング)、その構造を基に独特の運動を行う必要があります。タンパク質のフォールディングや機能発現の過程を理解し、人工的なタンパク質のデザインを可能にすることが求められています。
Proteins are natural polymers that perform various functions that sustain our lives. To be biologically active, proteins, need to form compact three-dimensional structures in the process called protein folding. In addition, the flexible movement of the folded structure is essential for the function of proteins. It is necessary to understand the processes of protein folding and function, and enable the design of artificial proteins.
研究の目標 Research Objective
我々は、独自に開発した一分子蛍光観察法を用いることで、タンパク質のフォールディング過程を直接観察し、タンパク質構造の構築原理の解明を目指しています。また、癌抑制タンパク質であるp53がDNA上におけるターゲット配列を探す過程の解明も目指しています。さらに、新規タンパク質をデザインする手法の開発にも取り組んでいます。
In our laboratory, we develop now single molecule fluorescence spectroscopy and observe the rapid process of protein folding directly. In addition, we observe the functional dynamics, a sliding motion along DNA, of a tumor suppressor p53. Furthermore, based on the knowledge of protein folding and function, we are developing a new strategy to design artificial proteins.
研究図Figures
論文発表 / Publications
Sci. Rep., 3, 2151 (2013). J. Am. Chem. Soc., 134, 11525 (2012). Adv. Chem. Phys. 146, 3 (2012).
研究者連絡先 / HP
- satoshi.takahashi.a6
 tohoku.ac.jp
tohoku.ac.jp - http://www2.tagen.tohoku.ac.jp/lab/takahashi-s/